18.03.2017
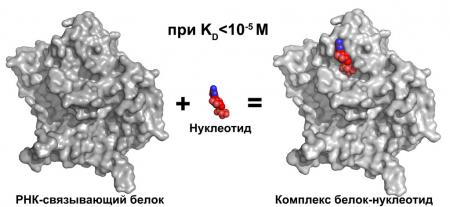
На протяжении своего существования в клетках молекулы рибонуклеиновых кислот (РНК) взаимодействуют с огромным количество разных белков. Такие белки зачастую определяют путь РНК в клетках, участвуя в процессах транскрипции и трансляции, в транспорте, локализации и маскировании мРНК и т.п. Исследование принципов РНК-белкового узнавания позволяет понять механизм реализации и регуляции перечисленных процессов на молекулярном уровне. Точное измерение сродства исследуемых белков к их РНК-мишеням необходимо для проведения фундаментальных исследований и имеет определяющее значение для решения прикладных задач в фармакологии и медицине, например, при разработке и тестировании лекарственных средств.
Ранее в Инстиуте белка РАН был предложен метод идентификации мест специфического узнавания оснований нуклеотидов на поверхности белков с помощью рентгеноструктурного анализа. Необходимым и важным подготовительным этапом такого подхода является оценка сродства нуклеотидов к белкам-мишеням, что позволяет избежать ненужных затрат времени и материалов на поиск условий кристаллизаций нестабильных комплексов.
В ходе проведенного исследования на большом ряде белков-регуляторов транскрипции и трансляции были определены пороговые значения равновесной константы диссоциации КD, при которых формируемый нуклеотид-белковый комплекс стабилен в условиях кристаллизации. Для измерения величины КD использовали простой и чувствительный метод измерения изменения анизотропии флуоресценции нуклеотидов при их взаимодействии с РНК-связывающими белками. Структуры комплексов получены с помощью методов рентгеноструктурного анализа. Сопоставление величин КD с наличием нуклеотидов в структурах предполагаемых нуклеотид-белковых комплексов показало, что рибонуклеотиды могут быть уверенно идентифицированы в комплексах с белком при величинах КD менее 10 мкМ, а при значениях выше 50 мкМ комплексы в условиях кристаллизации разрушаются.
Используя разработанную методику можно заранее отбраковать нестабильные в условиях кристаллизации нуклеотид-белковые комплексы и даже предсказать, какие из четырех типов оснований РНК исследуемый белок специфически узнает. Разработанная методика может стать надежным помощником для структурных исследований РНК-белковых взаимодействий.
Nemchinova M, Balobanov V, Nikonova E, Lekontseva N, Mikhaylina A, Tishchenko S, Nikulin A. An Experimental Tool to Estimate the Probability of a Nucleotide Presence in the Crystal Structures of the Nucleotide-Protein Complexes. Protein J. 2017 Mar 20. doi: 10.1007/s10930-017-9709-y.
Array
(
[und] => Array
(
[0] => Array
(
[value] =>
На протяжении своего существования в клетках молекулы рибонуклеиновых кислот (РНК) взаимодействуют с огромным количество разных белков. Такие белки зачастую определяют путь РНК в клетках, участвуя в процессах транскрипции и трансляции, в транспорте, локализации и маскировании мРНК и т.п. Исследование принципов РНК-белкового узнавания позволяет понять механизм реализации и регуляции перечисленных процессов на молекулярном уровне. Точное измерение сродства исследуемых белков к их РНК-мишеням необходимо для проведения фундаментальных исследований и имеет определяющее значение для решения прикладных задач в фармакологии и медицине, например, при разработке и тестировании лекарственных средств.
Ранее в Инстиуте белка РАН был предложен метод идентификации мест специфического узнавания оснований нуклеотидов на поверхности белков с помощью рентгеноструктурного анализа. Необходимым и важным подготовительным этапом такого подхода является оценка сродства нуклеотидов к белкам-мишеням, что позволяет избежать ненужных затрат времени и материалов на поиск условий кристаллизаций нестабильных комплексов.
В ходе проведенного исследования на большом ряде белков-регуляторов транскрипции и трансляции были определены пороговые значения равновесной константы диссоциации КD, при которых формируемый нуклеотид-белковый комплекс стабилен в условиях кристаллизации. Для измерения величины КD использовали простой и чувствительный метод измерения изменения анизотропии флуоресценции нуклеотидов при их взаимодействии с РНК-связывающими белками. Структуры комплексов получены с помощью методов рентгеноструктурного анализа. Сопоставление величин КD с наличием нуклеотидов в структурах предполагаемых нуклеотид-белковых комплексов показало, что рибонуклеотиды могут быть уверенно идентифицированы в комплексах с белком при величинах КD менее 10 мкМ, а при значениях выше 50 мкМ комплексы в условиях кристаллизации разрушаются.
Используя разработанную методику можно заранее отбраковать нестабильные в условиях кристаллизации нуклеотид-белковые комплексы и даже предсказать, какие из четырех типов оснований РНК исследуемый белок специфически узнает. Разработанная методика может стать надежным помощником для структурных исследований РНК-белковых взаимодействий.
Nemchinova M, Balobanov V, Nikonova E, Lekontseva N, Mikhaylina A, Tishchenko S, Nikulin A. An Experimental Tool to Estimate the Probability of a Nucleotide Presence in the Crystal Structures of the Nucleotide-Protein Complexes. Protein J. 2017 Mar 20. doi: 10.1007/s10930-017-9709-y.
[summary] =>
[format] => full_html
[safe_value] =>
На протяжении своего существования в клетках молекулы рибонуклеиновых кислот (РНК) взаимодействуют с огромным количество разных белков. Такие белки зачастую определяют путь РНК в клетках, участвуя в процессах транскрипции и трансляции, в транспорте, локализации и маскировании мРНК и т.п. Исследование принципов РНК-белкового узнавания позволяет понять механизм реализации и регуляции перечисленных процессов на молекулярном уровне. Точное измерение сродства исследуемых белков к их РНК-мишеням необходимо для проведения фундаментальных исследований и имеет определяющее значение для решения прикладных задач в фармакологии и медицине, например, при разработке и тестировании лекарственных средств.
Ранее в Инстиуте белка РАН был предложен метод идентификации мест специфического узнавания оснований нуклеотидов на поверхности белков с помощью рентгеноструктурного анализа. Необходимым и важным подготовительным этапом такого подхода является оценка сродства нуклеотидов к белкам-мишеням, что позволяет избежать ненужных затрат времени и материалов на поиск условий кристаллизаций нестабильных комплексов.
В ходе проведенного исследования на большом ряде белков-регуляторов транскрипции и трансляции были определены пороговые значения равновесной константы диссоциации КD, при которых формируемый нуклеотид-белковый комплекс стабилен в условиях кристаллизации. Для измерения величины КD использовали простой и чувствительный метод измерения изменения анизотропии флуоресценции нуклеотидов при их взаимодействии с РНК-связывающими белками. Структуры комплексов получены с помощью методов рентгеноструктурного анализа. Сопоставление величин КD с наличием нуклеотидов в структурах предполагаемых нуклеотид-белковых комплексов показало, что рибонуклеотиды могут быть уверенно идентифицированы в комплексах с белком при величинах КD менее 10 мкМ, а при значениях выше 50 мкМ комплексы в условиях кристаллизации разрушаются.
Используя разработанную методику можно заранее отбраковать нестабильные в условиях кристаллизации нуклеотид-белковые комплексы и даже предсказать, какие из четырех типов оснований РНК исследуемый белок специфически узнает. Разработанная методика может стать надежным помощником для структурных исследований РНК-белковых взаимодействий.
Nemchinova M, Balobanov V, Nikonova E, Lekontseva N, Mikhaylina A, Tishchenko S, Nikulin A. An Experimental Tool to Estimate the Probability of a Nucleotide Presence in the Crystal Structures of the Nucleotide-Protein Complexes. Protein J. 2017 Mar 20. doi: 10.1007/s10930-017-9709-y.
[safe_summary] =>
)
)
)


